


Представления о причинах и механизмах развития гастроэзофагеального рефлюкса и методах его лечения за истекшие два десятилетия претерпели существенные изменения. Прогрессивное увеличение распространенности симптомов заболевания среди различных групп населения экономически развитых государств выдвинуло ГЭРБ в ряд социально-значимых проблем.
В настоящее время не существует универсальной доктрины терапии гастроэзофагеальной рефлюксной болезни. Патогенетическая разнородность и многообразие клинических вариантов заболевания являются причиной имеющихся полярных подходов к коррекции ГЭРБ и ее осложнений.
Наиболее признанным на сегодняшний день основанием для выполнения антирефлюксного оперативного вмешательства считается развитие симптомов ГЭРБ у пациентов с хиатальными грыжами (грыжами пищеводного отверстия диафрагмы, рис. 1, 2).
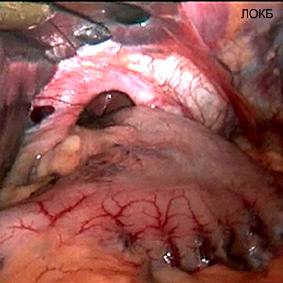
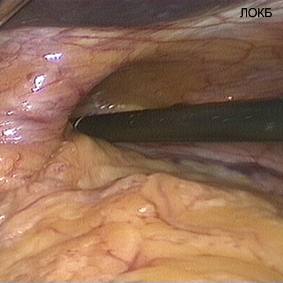
Рис.1 и 2. Хиатальная грыжа - причина гастро-эзофагеального рефлюкса (Интраоперационное фото)
Изменение естественных анатомических взаимоотношений в зоне гастроэзофагеального перехода относится к наиболее частым причинам механической несостоятельности нижнего сфинктера пищевода. Органическая причина заболевания предопределяет малую результативность химиотерапевтического воздействия на его разнообразные симптомы. С другой стороны, минимальные проявления гастро-эзофагеального рефлюкса, возникающего на фоне хиатальной грыжи, во многих случаях поддаются коррекции простыми изменениями режима или стандартной медикаментозной терапией. Таким образом, взвешенный подход к определению показаний для оперативного лечения ГЭРБ, обусловленной (или усугубляющейся) грыжей пищеводного отверстия диафрагмы, обязан учитывать тяжесть клинических проявлений гастроэзофагеального рефлюкса и его осложнений. Основанием для выполнения антирефлюксной реконструкции является резистентность пищеводных (или внепищеводных) проявлений заболевания к медикаментозной терапии. Кратковременный эффект консервативного лечения, необходимость постоянного приема антисекреторных препаратов, а тем более возникновение осложнений, в настоящее время рассматриваются в качестве объективных показаний к оперативному вмешательству.
Открытым до настоящего времени остается вопрос обоснованности хирургических реконструкций у пациентов с несостоятельностью замыкательной функции нижнего пищеводного сфинктера (НПС) (рис. 3, 4).
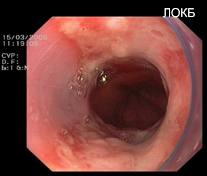
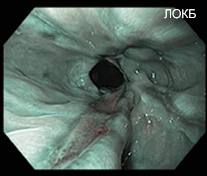
Рис. 3. Пептический эзофагит на фоне недостаточности НПС (Эзофагоскопия)
Рис. 4. Пептический эзофагит на фоне недостаточности НПС (Эзофагоскопия в режиме NBI)
Отсутствие четких представлений о причинах преходящей (или стойкой) релаксации НПС не позволяет сформулировать патогенетически оправданную стратегию их коррекции. Очевидно, что фармакологическое подавление секреторной активности желудка или стимуляция пропульсивной моторики пищевода являются недостаточно эффективными способами нивелирования повреждающего воздействия рефлюктата.
Механизм антирефлюксных хирургических вмешательств у пациентов с несостоятельностью нижнего эзофагеального сфинктера реализуется за счет моделирования из дна желудка конструкции “чернильницы-непроливайки” и компрессии дистального отдела пищевода фундальной муфтой.
Предметом активного обсуждения по-прежнему остается выбор лечебной стратегии у пациентов с гастроэзофагеальной рефлюксной болезнью, развившейся на фоне изменений перистальтической функции пищевода (рис. 5, 6).
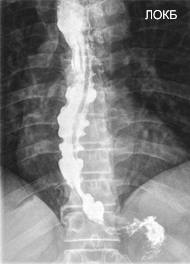
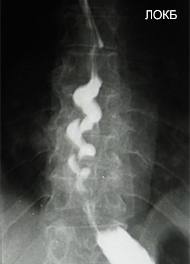
Рисунок 5. Диффузный эзофагоспазм на фоне эзофагита (картина “пилы”)
Рисунок 6. Диффузный эзофагоспазм на фоне эзофагита (картина “штопора”)
Рентгеноконтрастные исследования
Нейрофизиологические механизмы, лежащие в основе данных нарушений, подразумевают проведение химиотерапевтической стимуляции моторной функции органа на различном уровне. С другой стороны, не лишенной смысла в подобной ситуации представляется идея создания искусственного антирефлюксного барьера за счет расположения дна желудка выше дистального сфинктера пищевода. Воспроизведение модели “чернильницы-непроливайки” в зоне пищеводно-желудочного перехода без изменения функционального состояния кардии является теоретической базой всех парциальных фундопликаций. Оправданность выполнения подобных реконструкций в настоящее время не вызывает сомнений, и подтверждена многолетним клиническим опытом.
Таким образом, существующие в настоящее время взгляды на терапию данного варианта желудочно-пищеводного рефлюкса имеют свои отрицательные и положительные стороны. Вероятно, как и в любых спорных вопросах, истина заключена в разумном компромиссе между фармакологической и оперативной концепциями.
Доказанным и весьма распространенным механизмом возникновения гастроэзофагеального рефлюкса является стойкое повышение внутрижелудочного давления. В основе указанного состояния лежат различные виды нарушения эвакуаторной деятельности желудка или двенадцатиперстной кишки.
Выбор между хирургической (или эндоскопической) коррекцией и медикаментозной терапией данного состояния должен определяться его патофизиологическими причинами. Диабетическая гастроэнтеропатия, висцеральные мионейропатии, сопровождающиеся гипокинезией верхних отделов пищеварительного тракта, и некоторые другие состояния предусматривают терапевтическую тактику лечения. Напротив, механические причины гипертензии верхних отделов пищеварительного тракта (язвенный стеноз пилородуоденальной зоны или опухоли желудка, артериомезентериальная компрессия, крупный дивертикул двенадцатиперстной кишки) подразумевают хирургическое создание антирефлюксного барьера и надежное устранение причины повышения гастродуоденального давления.
Рассматривая показания к лечению ГЭРБ, нельзя не коснуться традиционно терапевтической области вопроса: снижения резистентности слизистой оболочки пищевода к повреждающему действию желудочного рефлюктата. На первый взгляд, подобная причина развития заболевания предусматривает исключительно фармакологический путь коррекции его клинических проявлений. Однако искусственное создание дополнительного препятствия минимальным по объему и кратковременным эпизодам гастроэзофагеального рефлюкса может быть эффективным способом устранения фактора агрессии. Разумеется, оперативное лечение в подобной ситуации не является методом выбора, и должно рассматриваться как запасной вариант при неудаче медикаментозной терапии.
При изложении современных тенденций хирургического лечения ГЭРБ представляется обоснованным отдельно остановиться на наиболее распространенных в повседневной практике осложнениях заболевания.
Наибольший интерес из названной группы состояний справедливо занимает феномен цилиндроклеточной метаплазии пищеводного эпителия (рис. 7, 8).
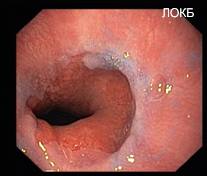
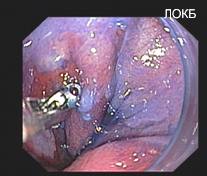
Рисунок 7 и 8. Цилиндроклеточная метаплазия на фоне пептического эзофагита (Хромо-эзофагоскопия )
Актуальность проблемы лечения пищевода Барретта определяется его известной ролью в патогенезе эзофагеальной аденокарциномы.
Следует отметить, что по мере расширения знаний о причинах и механизмах развития указанного синдрома, представления о рациональных подходах к терапии пищевода Барретта претерпели существенную эволюцию. Надежный медикаментозный контроль клинических проявлений (дуодено-) гастроэзофафагеального рефлюкса, отсутствие отрицательной эндоскопической и гистологической динамики, позволяют воздержаться от необоснованных оперативных вмешательств. Безопасность и рациональность подобной концепции нашли подтверждение в многочисленных исследованиях последнего времени.
В то же время, логичной представляется позиция сторонников активной хирургической тактики в отношении данного осложнения ГЭРБ. Бесспорной положительной стороной этого направления является идея однократной и радикальной редукции ключевого звена патогенеза цилиндроклеточной метаплазии пищеводного эпителия и устранения вероятного риска развития аденокарциномы.
Рассматривая вопрос целесообразности оперативного лечения пищевода Барретта, нельзя упускать из внимания роль дуодено-гастро-эзофагеального заброса в развитии заболевания. В арсенале современной фармакологии отсутствуют средства, устраняющие воздействие дериватов желчи на слизистый покров пищевода.
Отдельным вопросом лечебной стратегии при пищеводе Барретта остаются показания к проведению эндоскопической деструкции метаплазированного эпителия. С позиции современных знаний о морфогенезе аденокарциномы Барретта, выполнение абляции при различных вариантах желудочной транcформации слизистой оболочки пищевода считается необоснованным. Напротив, целесообразность осуществления данной процедуры при развитии кишечной метаплазии c неоплазией, до настоящего времени остается предметом дискуссии. Сторонники консервативной концепции в качестве показания к выполнению эндоскопической деструкции рассматривают прогрессирование диспластических нарушений на фоне проводимой фармакологической терапии.
Альтернативный подход предполагает превентивное устранение основного патогенетического фактора метаплазии – желудочно-пищеводного заброса и абляцию минимально опасных с точки зрения развития аденокарциномы Барретта участков слизистой оболочки пищевода. В качестве первого этапа лече-ния выполняется эндоскопическая деструкция измененного эпителия, далее - антирефлюксная реконструкция гастро-эзофагеального перехода (с возможной коррекцией желудочной или дуоденальной гипертензии).
Анализируя различные аспекты современных концепций лечения пищевода Барретта и профилактики эзофагеальной аденокарциномы, нельзя оставить без внимания социально-экономическую сторону проблемы. Однократно затратная, но радикальная хирургическая санация дает возможность отказаться от цепочки взаимосвязанных диагностических и фармакологических мероприятий.
Обсуждение различных осложнений гастро-эзофагеального рефлюкса не может не коснуться вопроса помощи пациентам с пептическими эзофагитами. Фармакологическое воздействие на тяжелые деструктивные изменения слизистой оболочки пищевода в подавляющем большинстве случаев имеет минимальный и непродолжительный эффект. Напротив, создание хирургического антирефлюксного барьера и коррекция желудочно-дуодено-гастральной гипертензии позволяют устранить ведущие факторы патогенеза заболевания и достичь надежного контроля его клинических проявлений.
Отдельной проблемой коррекции проявлений гастроэзофагеальной рефлюксной болезни считается развитие рубцового сужения дистального отдела пищевода (рис 9, 10).
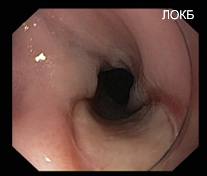
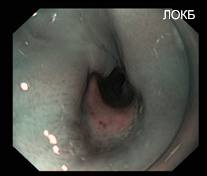
Рисунок 9. Пептическая язва и пептическая стриктура пищевода (Эзофагоскопия)
Рисунок 10. Пептическая стриктура пищевода (Эзофагоскопия в режиме NBI)
Клинико-морфологическими предпосылками формирования пептических стриктур являются эрозивно-язвенные эзофагиты. Преобладание в механизмах репарации поврежденных тканей фиброзного компонента приводит к уменьшению просвета органа (рис. 11, 12).
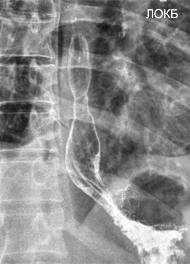
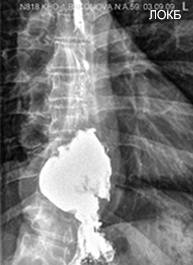
Рисунок 11. Короткая пептическая стриктура на фоне аксиальной (I тип) хиатальной грыжи
Рисунок 12. Короткая пептическая стриктура на фоне смешанной (III тип) хиатальной грыжи
Рентгеноконтрастные исследования
Спектр предложенных для лечения технологий весьма широк. Во многих случаях оправданной является тактика поддерживающего бужирования стриктур, проводимого на фоне комбинированной медикаментозной терапии. Своих сторонников имеют комбинации малоинвазивных оперативных методик: эндоскопическая дилятация сужения с последующей антирефлюксной реконструкцией, эндо- или лапароскопическое рассечение стриктуры, дополняемое фундопликацией, а также их различное сочетание.
Очевидно, выбор оптимального варианта лечения должен определяться клиническими проявлениями заболевания в каждом конкретном случае. Минимальные симптомы дисфагии, хороший и стойкий эффект эндоскопической дилятации сужения, надежный фармакологический контроль проявлений гастро-эзофагеального рефлюкса позволяют воздержаться от хирургических мероприятий. Напротив, развитие протяженной стриктуры пищевода, тяжелой дисфагии, непродолжительный положительный результат бужирования следует рассматривать в качестве абсолютного показания к оперативному лечению.
Рациональным подходом в подобной ситуации следует считать эндоскопическую дилятацию сужения с последующей антирефлюксной реконструкции пищеводно-желудочного перехода. Необходимость осуществления одномоментной эзофагопластики определяется индивидуально, и основывается на протяженности и степени выраженности рубцовых изменений пищевода.
Рассматривая частные вопросы лечения ГЭРБ, необходимо кратко остановиться на бессимптомном варианте заболевания. Клиническое значение данного состояния обусловлено сложностями его диагностики и доказанной ролью в развитии тяжелых осложнений желудочно-пищеводного рефлюкса. Терапевтическая стратегия у пациентов с латентным течением рефлюксной болезни должна отталкиваться от выявленных последствий заболевания (эзофагита, стриктуры или метаплазии) и причин их возникновения.
При развитии внепищеводных осложнений ГЭРБ выбор рациональной тактики лечения должен осуществляться коллегиально всеми заинтересованными специалистами. Невозможность адекватной медикаментозной коррекции рефлюкс-индуцированных изменений со стороны дыхательной, сердечно-сосудистой систем, глотки, гортани, полости рта и т.д. предусматривает необходимость хирургического лечения.
Резюмируя обзор имеющихся на сегодняшний день представлений о показаниях к оперативной коррекции различных вариантов течения ГЭРБ и ее наиболее распространенных осложнений, необходимо лаконично сформулировать основные положения современной хирургической доктрины.
В заключении хотелось бы отметить очевидную симптоматическую направленность и идеологическую неоднозначность представленных положений. Создание унифицированной лечебной концепции, учитывающей все возмож-ные варианты течения гастроэзофагеальной рефлюксной болезни, в настоящее время вряд ли осуществимо. Несовершенство современных представлений о механизмах желудочно-пищеводного рефлюкса, сложность выявления и коррекции его ключевых патогенетических факторов, позволяют рассматривать существующие практические и экспериментальные достижения в качестве промежуточного этапа решения проблемы. Дальнейшее развитие теории ГЭРБ, совершенствование клинических методов исследования, разработка новых фармакологических средств, без сомнения, составит фундамент будущих достижений в данной области практической медицины.
Материал подготовил Василевский Дмитрий Игоревич, кандидат медицинских наук, сотрудник хирургического отделения Ленинградской областной клинической больницы.
(Все иллюстрации являются оригинальными и принадлежат Ленинградской областной клинической больнице)